Focus métier – Dispositif Médical
Quand parler de dispositif médical ?
Le dispositif médical c’est : “Un produit […] exerçant une action de diagnostic, de prévention, de contrôle, de traitement ou d’atténuation d’une maladie par un processus principal n’étant pas d’ordre pharmacologique, immunologique ou métabolique.”
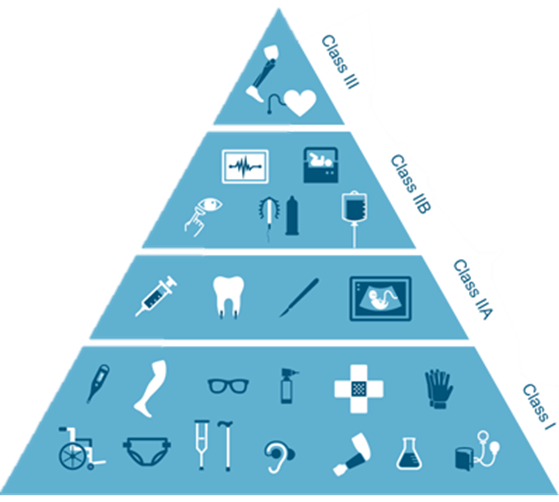
Les dispositifs médicaux sont classés selon le risque lié à leur utilisation, implantation ou maintenance : de I à III (le plus risqué)
Quel est l’avenir du dispositif médical ?
Depuis le 26 mai 2021, un nouveau règlement européen (2017/745) est entré en application. Dès lors, les fabricants ont trois ans pour se contraindre aux nouvelles demandes.

Ces grands changements concernent :
- SECURITE : Niveau de démonstration de la sécurité et du bénéfice clinique revu à la hausse
- UNIFORMISATION : Application de la réglementation de la même façon dans toute l’UE
- ACTEURS : Précision des obligations de tous les acteurs de la chaîne, de la fabrication à la distribution
- PRODUITS : Encadrement de produits sans finalité médicale utilisant les mêmes technologies
- TRACABILITE : Mise en place de l’identifiant unique des dispositifs (IUD)
- TRANSPARENCE : Précision des notices, carte d’implants, base de données EUDAMED
Si ces changements répondent à une demande des utilisateurs, ils amènent leurs lots de contraintes, comme l’ont souligné récemment les Académies de Médecine, Pharmacie et Chirurgie.
Quatre grands problèmes ont ainsi été soulevés :
- La nouvelle réglementation ne tient pas compte du passif établi de nombreux
dispositifs médicaux, notamment parmi les dispositifs implantables - Les Organismes Notifiés sont en nombre insuffisant. De plus de 50 sous la directive,
il n’en reste actuellement que 28 en Europe, dont un seul en France : le LNE-GMED - Le nombre de dépôt de dossiers est en forte augmentation chaque année
- Le nombre d’experts est insuffisant, tant au sein des ON que chez les industriels
Plusieurs risques majeurs sont ainsi identifiés :
- Le blocage du système et la pénurie de certains dispositifs dès le 26 mai 2024
- Un sacrifice inévitable du progrès au profit des dispositifs médicaux déjà établis afin de les sauver de la perte de leur marquage CE
- La suppression de certaines gammes de dispositifs de « niches » jugés trop peu rentables, et qui demeurent pourtant indispensables à certains patients
- La disparition pressentie de certaines entreprises aux moyens trop modestes pour faire face aux nouvelles exigences, ou pour attendre leur certificat
Afin de ne pas tomber dans ces écueils, les Académies suggèrent un report de la date limite d’au moins deux ans, ainsi qu’un renfort considérable des effectifs à même de traiter les dossiers de marquage CE, tant côté Organisme Notifié que côté Fabricant.
Les considérations réglementaires, déjà tendues ces dernières années, semblent ainsi destinées à devenir un enjeu majeur au cours de la période à venir.